Aucun produit
Produit ajouté au panier avec succès
Il y a 0 produits dans votre panier. Il y a 1 produit dans votre panier.
Mikrogeophagus ramirezi
- Elevages européens
- Nouveau
- 9
Cichlidés nains Sud américain - Mikrogeophagus ramirezi - Papiliochromis ramirezi - Apistogramma ramirezi
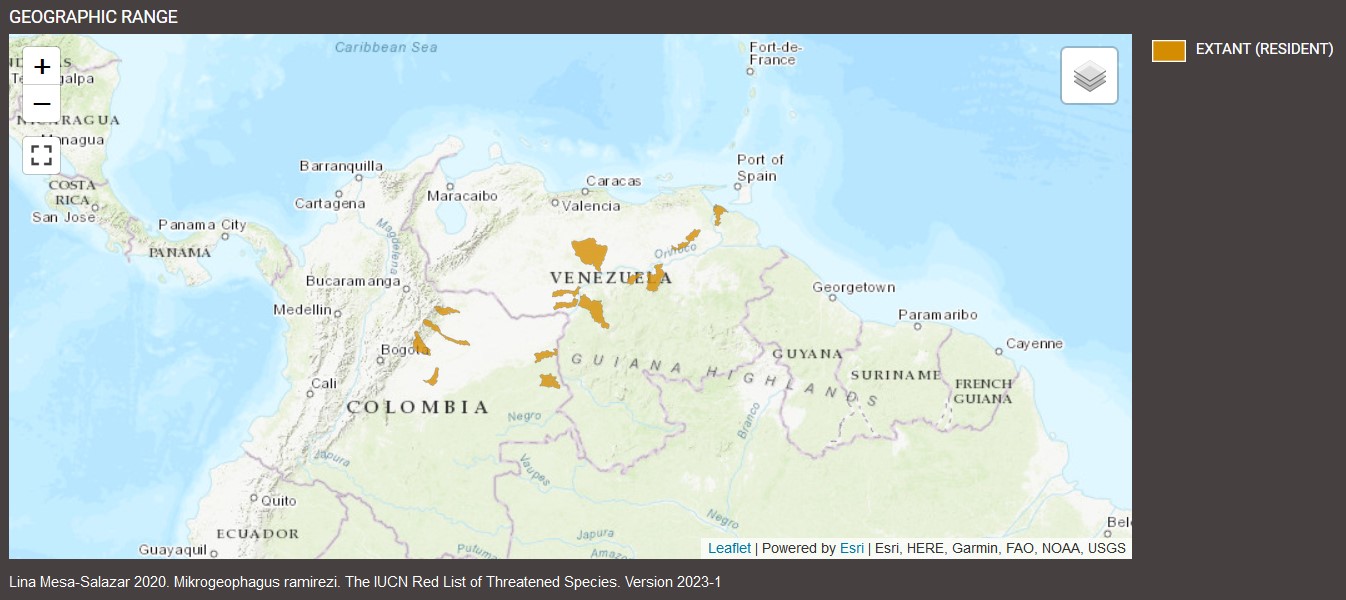
Distribution: La majorité de la littérature suggère que cette espèce est limitée aux llanos vénézuéliens et colombiens du drainage du Río Orinoco, bien que l'un des spécimens de nos images aurait été collecté dans le rio Purus, au Brésil, un affluent de l'Amazone situé à une certaine distance de ce bassin versant.
Les Llanos sont un vaste système riche en biodiversité composé de prairies de savanes tropicales, de plaines inondées de façon saisonnière et de forêts couvrant une superficie de près de 600 000 kilomètres carrés au Venezuela et en Colombie. Il existe des régimes climatiques annuels bien définis, avec des saisons humides et sèches distinctes et des températures élevées tout au long de l'année.
On le trouve dans les contreforts andins de l'Orénoque, dans les rivières Cusiana (Urbano-Bonilla et al. 2018), Pauto (Maldonado-Ocampo et al. 2013) et dans le bassin fluvial du Casanare (Zamudio et al. 2017, Mesa et al. 2017, Mesa et al. 2017). al.2019). Dans les hautes plaines de Colombie, on le trouve dans les rivières Manacacias (Galvis et al. 2007) et Vichada (Lasso et al. 2004), dans les hautes plaines du Venezuela, dans les rivières Aguaro, Guariquito, Manapire (Marcano et al. 2007, Machado-Allison et al. 2018) et Morichal Largo à l'est (Lasso et al. 2004). Dans le delta de l'Orénoque, on le trouve dans les canaux Pedernales et Cocuina (Mesa et al. 2011). Dans la dépression Arauca-Apure, on le trouve dans les rivières Cinaruco, Capanaparo (Lasso et al. 2004) et Apure. Alors que, dans la région d'influence du plateau guyanais en Colombie, on le trouve dans les rivières Inírida et Lower Guaviare (Lasso et al. 2009) et au Venezuela, dans les rivières Suapure, Caura, Pao et Aro (Lasso et al. 2004). ). Sa localité type est le système de l'Orénoque, au Venezuela (Myers et Harry, 1948).
Biotopes: Démersal. On le trouve dans les rivières et les marécages/lagunes morichaux (caractéristiques de la présence du palmier Mauritia flexuosa) à fonds fermes et sableux, recouverts d'une abondante matière organique en décomposition. Il vit dans une eau transparente qui permet la pénétration de la lumière. Ces rivières drainent les sols de la savane et l'eau est donc très pauvre en nutriments, avec des valeurs de conductivité allant de faible à intermédiaire et une acidité allant d'élevée à légèrement basique (Mesa et Lasso 2013). Les valeurs pour la rivière Manacacias sont la conductivité de 4,5 et le pH de 5,5 (Galvis et al. 2007) ; pour la rivière Morichal Largo, pH 5,1-6,5 et conductivité de 17-45 µS/cm, avec une eau couleur thé et une faible teneur en oxygène dissous (1-4 mg/l) (Mora et al. 2008) ; dans la partie inférieure des rivières Guaviare et Inírida, les valeurs physico-chimiques approximatives sont un pH de 7,3 et une conductivité de 10 µS/cm (Galvis et al. 2007). Les ruisseaux et les lagunes du cours inférieur et moyen du fleuve Capanaparo (« plaines éoliennes ») présentent des valeurs de pH (de 5,9) et de conductivité (55,3 µS/cm) modérées près de son embouchure dans le fleuve Orénoque (Yanez et Ramírez 1988). Alors que pour la rivière Caura, le pH est compris entre 5,04 et 5,82 et la conductivité est comprise entre 6 et 20 µS/cm (Riseng et Spark 2003).

Sympatrie: Parmi les autres poissons présents dans la région figurent Corydoras delphax, Platydoras costatus, Baryancistrus beggini, Hypancistrus inspecter, Panqolus maccus, Panaque nigrolineatus, Hemigrammus rhodostomus, H. stictus, Hyphessobrycon sweglesi, Paracheirodon axelrodi, Pristella maxillaris*, Copella nattereri, Biotodoma wavrini, Geophagus abalios, Heros severus, Mesonauta insignis, le démon Satanoperca et Uaru fernandezyepezi.
*J'observe que les sujets juvéniles s'insèrent régulièrement à l'intérieur du banc de Pristella, lorsqu'il est compacte, en éclaircissant leur patron au même ton que le banc, et suivent la course de celui-ci pendant plusieurs minutes.
Décoration: Racines, plantes, feuilles mortes.
Substrat: Fin.
Brassage: Uniquement lent pour les juvéniles, jusqu'à modéré/fort pour les sujets adultes.
Statut de protection: Préoccupation mineure (Least Concerned).
Menaces: Son aire de répartition se situe sur la zone d’exploitation pétrolière des blocs Ayacucho et Carabobo (Barreto 2017), au nord-est du Venezuela. Dans les contreforts colombiens, il s'agit de zones affectées à l'exploration d'hydrocarbures, avec l'attribution officielle de blocs importants dans la plupart des départements de Meta et Casanare (ANH 2020). L’exploitation du pétrole lourd contribue à la destruction des milieux morichaux, ce qui signifie une perte d’habitat pour les espèces aquatiques. Les déversements accidentels et l'eau dérivée de cette activité salinisent les eaux des rivières, augmentent le CO2 et la température de l'eau et réduisent la transparence et la productivité du système (Valois et Rial 2011, Machado-Allison 2017). Dans les contreforts colombiens, il existe des matrices transformées par la pâte à papier et les plantations non ligneuses, les plus importantes étant celles du palmier africain et du riz, mais il existe également d'autres cultures pérennes et transitoires (Torres-Mora et al. 2015). Dans le delta de l'Orénoque, la fermeture du barrage du canal de Manamo a modifié les conditions physico-chimiques de l'eau depuis 45 ans, cette salinisation permet la colonisation de nouveaux milieux par différents éléments de la faune estuarienne-marine (poissons et macroinvertébrés) qui pourraient être des concurrents ou des prédateurs potentiels. En outre, dans la région de Caño Pedernales, il existe des menaces potentielles liées aux marées noires occasionnelles et à la croissance du trafic naval qui augmente le taux d'immigration et l'introduction d'espèces exotiques (Lasso et Sánchez-Duarte 2011). Dans l'État de Bolivar au Venezuela, la pression est due à l'exploitation minière des blocs Juana La Avanzadora et Negra Hipólita, de l'arc minier de l'Orénoque, où sont officiellement exploités la bauxite, le kaolin, le granit, le fer, l'or et les diamants (Ministerio del Poder Popular pour le Développement Minier Ecologique 2020). En outre, l'exploitation minière illégale est documentée pour le bassin versant supérieur des rivières Suapure, Caura et Aro (Chernoff et al. 2003, Nuñez 2016), avec tout ce que cette activité implique pour l'écosystème, la destruction de l'habitat et la contamination de l'environnement. plans d’eau contenant du mercure et d’autres résidus provenant de l’activité minière.
Mode de vie sociale: Territorial, couple.
Taille adulte: 4 cm SL*
Comportement: Paisible. Les facteurs physico-chimique de l'eau tendent à influer sur le caractère territorial de l'espèce. Ainsi plus on se rapprochera des conditions idéales de frai (pH bas, Brassage lent, T° élevée), Plus l'agressivité sera marquée. Pour ces raisons je déconseille l'acclimatation et la maintenance en pH acide tant que la ou les femelles ne sont pas matures et gravides.
Éclairage: Tamisé
Étymologie:
- Mikrogeophagus : grec, mikros = petit + grec, gea = terre + grec, phagein, manger.
- ramirezi : apparemment choisi pour éviter toute confusion car le nom « ramirezi » était utilisé dans le commerce avant sa description.
T° optimales: 27 à 30°C.
Cycle: Diurne.
Ration quotidienne: Un dizième de pincée. granulés coulants de protéines d'origines animales 0,7 mm pour les juvéniles, 1 mm pour les sujets adultes, les pastilles de fonds sont un bon complément. Le genre est lent à la prise de nourriture et de ce fait sensible à la concurrence alimentaire générée par les espèces trop vives, en particulier de banc, il convient donc de bien sélectionner les cohabitants de cette niche trophique: Je recommande particulièrement les genres Nannostomus, Copella, Carnegiella, Axelrodia et dans le genre Hyphessobrycon les espèces H. amandae et H. elachys. Pour les espèces plus grosses il est aussi possible d'associer les espèces qui supportent la vie en groupe modeste, comme par exemple H. megalopterus et H. sweglesi.
Enfin, le genre a des moeurs benthiques, c'est à dire qu'il est inféodé au substrat et qu'il y puise naturellement son alimentation, bien que de manière moindre que le genre Apistogramma. Les sujets nouvellement acquis, très souvent en cours de croissance, n'ont pas toujours le réflexe d'aller chercher leur alimentation à la surface. C'est un comportement qu'ils peuvent cependant acquérir avec le temps. Aussi je recommande chaudement, surtout pour les sujets jusqu'à un calibre de 3 à 4 cm, une acclimatation dans un volume inférieur ou égal à 150 litres avec une hauteur d'eau maximale de 30 cm, en monospécifique ou accompagné d'espèces exerçant une faible concurrence alimentaire (Corydoras, Loricaridés, Nannostomus, etc...). N'envisagez une acclimatation en bac d'ensemble qu'à partir d'une taille supérieure à 4 cm.
Maintenance: Nécessite un aquarium avec filtre, chauffage et éclairage et dont l'écosystème est équilibré (ayant a minima 3 semaines de mise en route, parfois plus). Mikrogeophagus ramirezi semble moins tolérent aux biotopes lentique que le genre Apistogramma et je ne recommande pas un brassage trop faible pour sa maintenance, ni l'apport de CO2.
Notes: De nombreuses sélections de formes et de couleurs ont été développées (Gold, blue, black, lyre, ballon). Bien qu'il arrive de trouver des sujets de ces formes de bonne qualité, cela n'est pas monnaie courante: En effet, l'attention des éleveurs étant focalisée sur les couleurs recherchées, on observe un fort pourcentage de sujets dont la silhouette laisse à désirer dans ces productions. D'une manière générale ces productions tendent à s'appauvrir en couleurs de reflets.
On trouve aussi une souche dite "ASIA" de taille plus imposante. La forme de ces poissons n'a plus rien à voir avec le morphe d'origine, avec par exemple une bouche dirigée vers le haut et plate. Les couleurs de reflets sont pratiquement absentes sur cette forme.
Informations sur le genre: Le genre Mikrogeophagus ne contient actuellement que deux espèces reconnues. Ils sont séparés l'un de l'autre sur le plan géographique, M. ramirezi étant présent au Venezuela et en Colombie et son congénère M. altispinosa originaire de Bolivie et de l'ouest du Brésil. Ce dernier est également un poisson plus gros et moins coloré, dépourvu de marques bleues irisées sur les nageoires, le corps et la tête.
Le groupe a une histoire taxonomique confuse avec le placement et l'orthographe corrects de l'espèce type M. ramirezi, source de confusion pendant plusieurs décennies avant la publication de Kullander (2011). Il a été décrit comme membre du genre Apistogramma mais affilié plus tard au nom Microgeophagus dans un livre d'aquarium de Hans Frey (1957) qui n'a pas fourni de caractères diagnostiques et a seulement suggéré qu'il pourrait être placé dans ce genre à l'avenir.
Ce dernier nom n'a été généralement accepté qu'en 1971, lorsqu'Axelrod l'a utilisé dans un livre populaire sur l'élevage de poissons d'aquarium, bien que Klee (1971) l'ait rejeté et a suggéré que l'espèce soit plutôt incluse dans Geophagus. Kullander (1977) a décrit le nouveau genre Papiliochromis avec P. ramirezi comme espèce type et, dans le même article, a considéré Microgeophagus comme un nom indisponible sans fournir de détails précis sur les raisons.
Papiliochromis a été accepté dans la littérature amateur et scientifique jusqu'à ce que Bailey et Robins (1982) concluent que Microgeophagus sensu Axelrod (1971) était le nom disponible le plus ancien pour un genre de cichlidé avec A. ramirezi comme espèce type, et devrait donc être considéré comme valide.
Géry (1983, 1986) a soutenu que Microgeophagus sensu Frey (1957) est le nom disponible le plus ancien pour le genre, tandis qu'Allgayer (1985) considérait Papiliochromis valide. Kullander (1998) a utilisé Mikrogeophagus, un nom qu'il considérait comme le plus ancien disponible en raison de son inclusion comme nom valide dans Jeg har akvarium, un livre d'aquarium en langue danoise publié en 1968, avec Microgeophagus sensu Frey (1957), un nomen nudum indisponible dépourvu à la fois d'un diagnostic et espèce type.
Le genre Mikrogeophagus est donc attribué à Jens Meulengracht-Madsen, 1968, auteur des sections pertinentes du livre (il a été édité par Schiøtz et Christensen), mais il est considéré comme un acte nomenclatural « involontaire » car l'auteur pensait qu'il utilisait un nom existant.
Le Mikrogeophagus est donc devenu largement accepté à la suite de Kullander (1998), bien qu'un certain nombre d'auteurs ne soient évidemment pas d'accord.
Après une période d'inactivité, Isbrücker (2011) a rouvert la question et a soutenu que Microgeophagus sensu Frey (1957) est en fait le nom le plus ancien disponible pour le genre, mais cela a été définitivement rejeté par Kullander (2011) qui a publié une analyse détaillée des différents noms génériques qui ont été utilisés pour l'espèce, dont la majorité sont dérivés de la littérature aquariophile plutôt que scientifique.
Bien que Mikrogeophagus soit maintenant généralement accepté comme étant correct, l'espèce M. ramirezi apparaît généralement dans la littérature sur les aquariums plus anciennes sous le nom d'Apistogramma ramirezi, Microgeophagus ramirezi ou Papiliochromis ramirezi.
Informations sur la famille:
Kullander (1998) a mené une étude phylogénétique basée sur la morphologie dans laquelle la famille néotropicale Cichlidae a été divisée en six sous-familles dont la sous-famille putative Geophaginae contenait 16 genres répartis en trois «tribus»:
Acarichthyini – Acarichthys et Guianacara.
Crenicaratini – Biotoecus, Crenicara, Dicrossus et Mazarunia.
Geophagini – Geophagus, Mikrogeophagus, groupe « Geophagus » brasiliensis, groupe « Geophagus » steindachneri, Gymnogeophagus, Satanoperca, Biotodoma, Apistogramma, Apistogrammoides et Taeniacara.
Des études moléculaires ultérieures par Farias et al. (1999, 2000, 2001) ont abouti à l'ajout de Crenicichla et Teleocichla aux Geophaginae, un résultat soutenu par López-Fernández et al. (2005) qui ont mené l'analyse moléculaire la plus détaillée du groupement à ce jour, y compris 16 des 18 genres et 30 espèces. Cependant, leurs conclusions concernant les interrelations entre les genres variaient quelque peu des hypothèses précédentes et peuvent être résumées par les groupes vaguement définis suivants:
- une relation de groupe sœur faiblement soutenue entre Acarichthys et Guianacara.
– un « clade Satanoperca » bien soutenu comprenant Satanoperca, Apistogramma, Apistogrammoides et Taeniacara.
– un « grand clade » avec Geophagus, Mikrogeophagus, groupe ‘Geophagus‘ brasiliensis, groupe ‘Geophagus‘ steindachneri, Gymnogeophagus, Biotodoma, Crenicara et Dicrossus.
– un « clade des crénicarines » avec Biotoecus et Crenicichla.
Aucun représentant de Teleocichla ou Mazarunia n'a été inclus dans l'étude, mais le premier est bien établi en tant que sœur de Crenicichla tandis que ce dernier s'est étroitement regroupé avec Dicrossus et Crenicara dans des travaux antérieurs. Les autres principales conclusions de l'article sont la confirmation que Geophaginae est un groupe monophylétique présentant de forts signes d'avoir subi une radiation adaptative rapide (diversification d'une espèce ou d'un type ancestral unique en plusieurs formes qui sont chacune spécialisées de manière adaptative dans une niche environnementale spécifique).
Longévité: Inconnue
Afin de préserver la vie sauvage, l’animal dont vous venez de faire l’acquisition ne doit en aucun cas être relâché dans le milieu naturel
*SL = Standard Length, mesure ne comprenant pas la nageoire caudale.
- Ton général de l'espèce Jaune
- Mode de reproduction Ovipare (pondeur sur substrat découvert)
- Origines Amérique du Sud
- Zone de vie Tiers inférieur
- Volume minimum 150 litres
- Volume minimum conseillé 240 litres









